《Matter》:天然细胞外基质水凝胶,通过选择性营养限制实现高炎症性饥饿治疗
军工资源网 2022年12月23日生物进化出毛细血管来维持循环系统,持续有效地提供氧气和营养物质,以满足体内每个细胞的代谢需求。然而,生理条件下充足的营养供应在病理条件下(通常在炎症条件下发现)具有相反的作用。高活性免疫细胞的特征是有氧糖酵解速率显著上调(瓦伯格效应)和对葡萄糖的需求急剧增加。失控的慢性炎症会耗尽其他细胞和组织的营养,导致机体内稳态失衡(如组织修复受损)。同样,营养物质的长期过量供应也可能导致代谢功能障碍。在这种代谢过剩的情况下,就会发生恶性循环。代谢信号可能触发炎症反应,而炎症反应进一步破坏代谢功能,进而导致更多的应激和炎症。

基于此,浙江大学林贤丰医师、范顺武教授和刘超研究员开发了一种天然的、生理触发的、可注射的、基于纳米血小板囊泡的细胞外基质水凝胶(NPV-ECM)。作为概念验证,在代表性的过度炎症性疾病糖尿病创面中,研究者证明了NPV-ECM可以基于分子间相互作用选择性调节营养转运,重塑局部免疫微环境,限制过度代谢状态,促进血管生成,实现创面愈合。进入临床后,研究者在糖尿病足溃疡患者中开展了一项临床试验,以验证NPV-ECM的安全性和治疗效果。本研究为天然ECM生物材料的制备和用于过度炎症饥饿治疗提供了理解。相关工作以“A natural extracellular matrix hydrogel through selective nutrient restriction for hyperinflammatory starvation therapy”发表在《Matter》。
【文章要点】
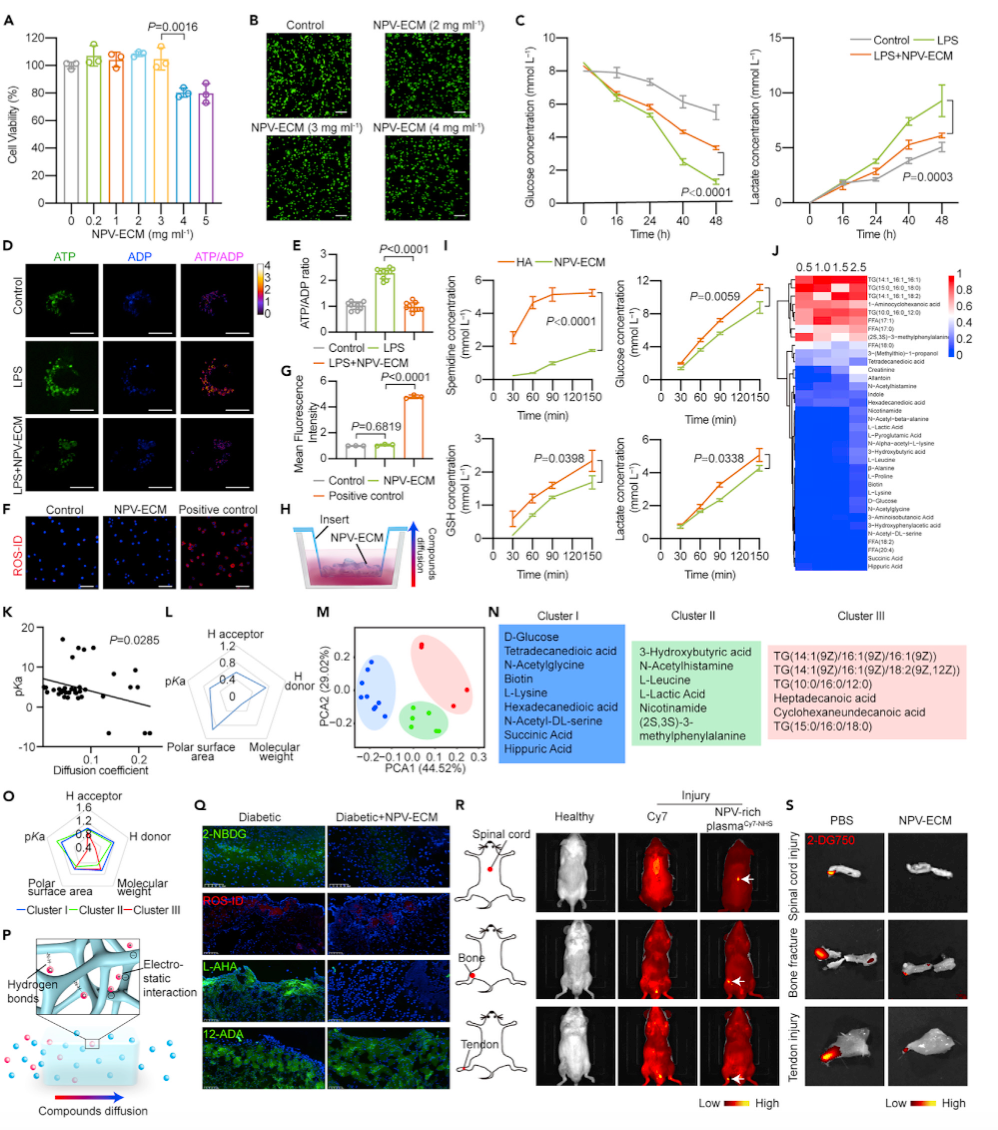
图1. 纳米血小板囊泡细胞外基质的制备与表征
NPV-ECM的制备与表征
研究者首先从血小板中制备NPV;通过挤压,可获得纳米级血小板(图1A)。血小板微粒(PMPs)已被证明是血小板激活后产生的细胞外囊泡(EVs) ,并且是细胞来源的天然EVs (nEVs),通过挤压获得的NPV是“人工EVs”,其原理是脂质和脂质膜自组装成球形结构,并将周围材料封装到生成的纳米囊泡的房水腔中。研究者用动态光散射(DLS)分析了NPV,并测量了表面Zeta电位。血小板粒径为1.24 微米,NPV粒径为34.3 纳米(图1B)。NPV的表面Zeta电位小于血小板(图1C)。冷冻透射电子显微镜(cryo-TEM)证实了NPV纳米结构(图1D)。接下来,研究者使用蛋白质组学来比较NPV和血小板的组成(图1E)。大部分蛋白质成分保存较好,不同的蛋白质成分主要集中在一些细胞质蛋白上,如甘油醛-3-磷酸脱氢酶(GAPDH)和肌动蛋白(ACTG1)(图1F)。对蛋白质组学结果进行基因本体论(GO)分析。结果表明,NPV保留血小板源性膜蛋白,也含有凝血相关蛋白。
图2. NPV-ECM的抗炎机制和选择性渗透性
NPV-ECM选择性渗透营养物质的炎症饥饿效应
在开始细胞和动物实验之前,研究者用水凝胶孵育骨髓源性巨噬细胞(BMDMs),并在24小时期间追踪细胞活力。在0 ~ 3 mg L-1的纤维蛋白原浓度下,NPV-ECM对未活化巨噬细胞的活力无影响(图2A)。这一点经活/死染色测定证实(图2B)。在活/死细胞染色实验中,NPV-ECM (4 mg mL-1纤维蛋白原)未引起细胞死亡,未见明显的碘化丙啶(PI)荧光。然而,在细胞计数试剂盒(CCK-8)实验中,NPV-ECM (4 mg mL-1纤维蛋白原)降低了光密度450 (OD450)值。这可能是由于高浓度的NPV-ECM减弱了未活化巨噬细胞的代谢活性和呼吸,从而减少了黄色甲醛的产生。脂多糖(LPS)激活的巨噬细胞增强糖酵解并关闭氧化代谢。葡萄糖利用上调和糖酵解通量增加对于满足促炎巨噬细胞的生物能需求是必需的。由于我们发现巨噬细胞可以被NPV-ECM捕获,因此研究者推测NPV-ECM可能能够调节细胞代谢。为了验证这一假设,研究者测定了LPS诱导的巨噬细胞中的葡萄糖和乳酸水平。NPV-ECM治疗后,葡萄糖消耗和乳酸生成显著减少(图2C)。
基于分子间相互作用的NPV-ECM的选择性渗透性
研究者研究了NPV-ECM对人血清中主要成分扩散的影响。采用液相色谱-质谱联用(LC-MS)对NPV-ECM中扩散的分子进行鉴定和测定。在2.5 h内,NPV-ECM对不同分子表现出选择性的通透性(图2J)。分子扩散的速率取决于分子的结构。为了证明这一点,研究者绘制了扩散效率和酸解离常数(pKa)之间的散点图。由图2K可知,随着pKa值的减小,分子的扩散效率增加。一个变量不足以反映NPV-ECM的选择性通透性。从Scifinder或人类代谢组数据库(HMDB)中获得代谢物的分子量、H受体、H供体、极性表面积和pKa数据,并进行线性回归分析。计算各变量的权重,并将其T因子显示在雷达图中。pKa和H供体与扩散效率呈强线性关系(p < 0.05)(图2L)。总的来说,NPV-ECM通过多种因素影响分子的扩散。我们还对分子进行了主成分分析(PCA),并通过评估PCA点的邻近性对这些分子进行分类。分子可以分为三个不重叠的簇(图2M)。簇I中的任何分子都不能穿透NPV-ECM膜,包括d -葡萄糖和琥珀酸盐,它们被认为可以促进经典活化巨噬细胞的炎症状态(图2N)。簇III中的分子表现出最强的扩散能力,包括替代活化巨噬细胞所需的甘油三酯和长链脂肪酸(图2N)。我们分析了三个集群的结构特征。图2O中的雷达图显示了三个簇的分子特征,pKa和H供体较低的分子穿透NPV-ECM膜的阻力最低。
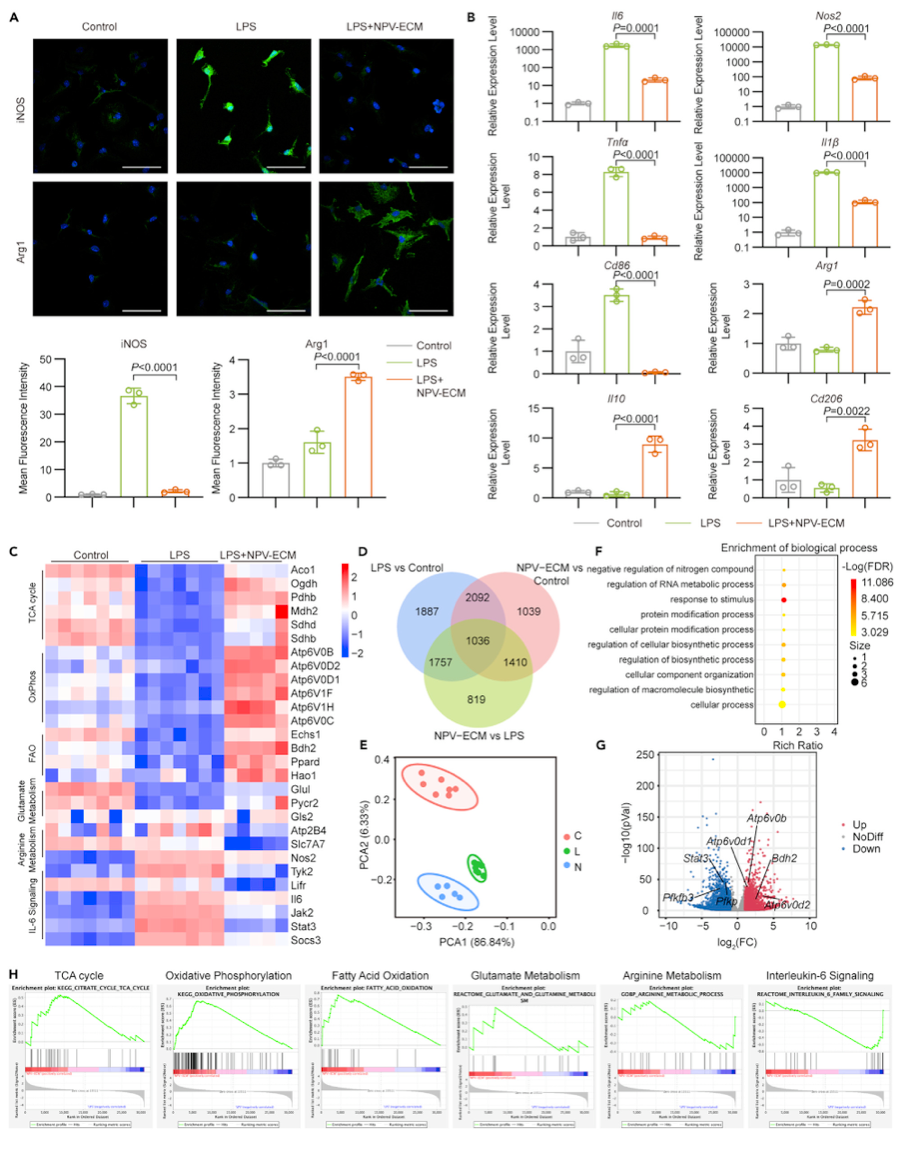
图3. NPV-ECM抑制LPS刺激巨噬细胞的炎症反应
NPV-ECM通过饥饿效应重新连接炎性巨噬细胞代谢网络
然后研究者检测LPS刺激的巨噬细胞在NPV-ECM上的体外免疫荧光染色。诱导型一氧化氮合酶(Inducible nitric oxide synthase, iNOS)和精氨酸酶1 (arginase 1, ARG1)被广泛用作促炎和抗炎巨噬细胞的标志物。正如预期的那样,与LPS刺激的巨噬细胞相比,NPV-ECM上培养的细胞显示出低得多的iNOS荧光和高得多的ARG1荧光(图3A)。采用定量聚合酶链反应(qPCR)检测促炎巨噬细胞标志物(Il6、Nos2、Tnfa、Il1b、Cd86)和抗炎巨噬细胞标志物(Arg1、Il10、Cd206)的mRNA水平。与lps刺激的巨噬细胞相比,NPV-ECM的抗炎作用得到了证实(图3B)。
根据这些结果,研究者推测NPV-ECM可能引起巨噬细胞的全身性代谢重编程。对LPS刺激的巨噬细胞进行转录组学和代谢组学分析。在三组中,研究者总共确定了30,874个基因和10,040个差异表达基因(图3C、3D)。PCA发现,对照组、LPS组和LPS+NPV-ECM组的基因在空间上存在高度差异(图3E)。LPS诱导的炎症巨噬细胞合成代谢所需的能量增加。这与研究则的GO分析一致,其中差异表达基因主要富集在生物合成过程(图3F)。
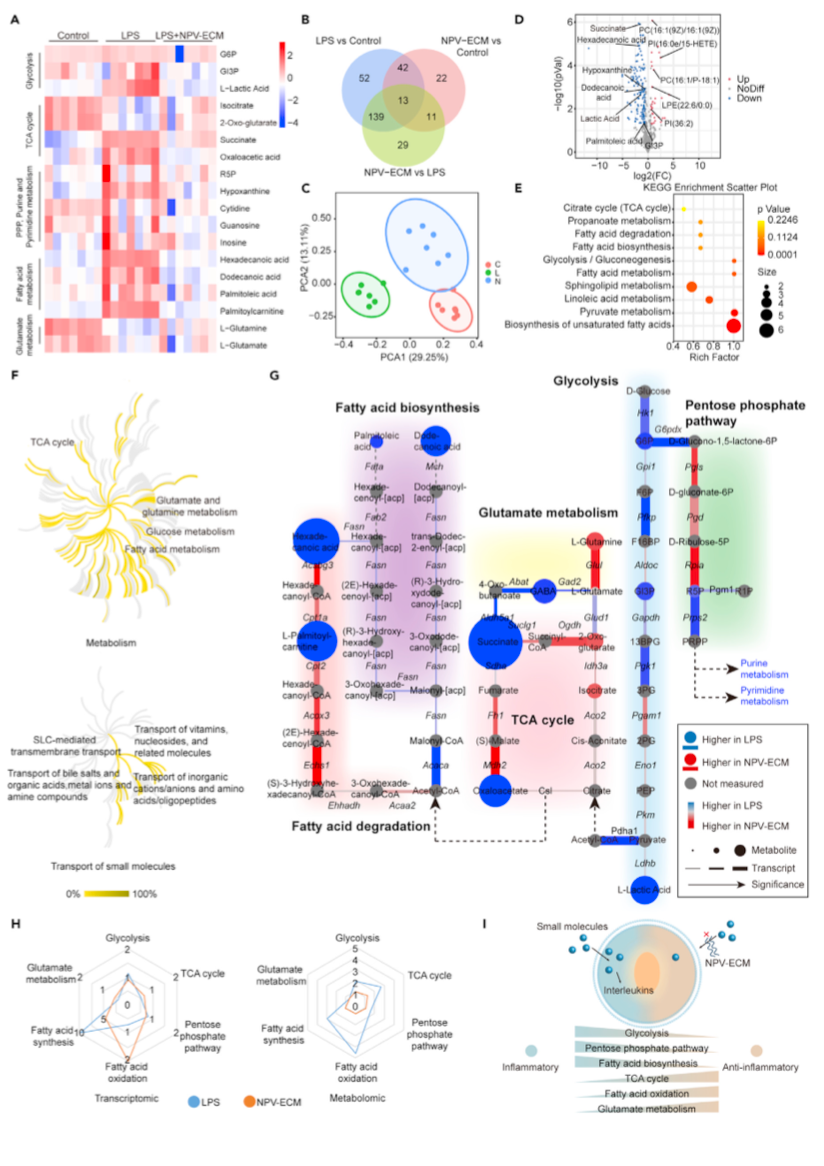
图4. NPV-ECM通过饥饿效应重新连接促炎巨噬细胞的代谢网络
采用代谢组学方法进行代谢物检测。共鉴定出678种代谢物。以p < 0.05和倍数变化> 50%为统计阈值,在3组中鉴定出308种差异丰富的代谢物(图4A、4B)。PCA显示,LPS+NPV-ECM组的代谢物与LPS组不同(图4C)。与LPS组相比,NPV-ECM增加了32个代谢物,减少了160个代谢物(图4D)。增加的代谢物主要为甘油磷脂,这与上述脂质容易穿透NPV-ECM的结果一致。NPV-ECM减少了乳酸和3-磷酸甘油醛(Gl3P)等糖酵解中间产物的积累。既往研究表明,LPS可引起琥珀酸(TCA循环中间体)积累;研究者的研究结果证实了这一点。NPV-ECM可以减少琥珀酸的蓄积。NPV-ECM降低了LPS刺激的脂肪酸合成(FAS)率,表现为降低了十二烷酸、棕榈油酸和十六烷酸的代谢产物水平。NPV-ECM还减少次黄嘌呤,嘌呤代谢的产物。这些结果表明,NPV-ECM可以减少高活性细胞能量和核酸合成底物的供应。通过京都基因和基因组百科全书(KEGG)分析,发现差异丰富的代谢物富集于不饱和脂肪酸的生物合成、糖酵解和TCA循环(图4E)。随后,使用Reactome数据模型在多个网络中建立了差异丰富的代谢物相关反应的等效性。与LPS组相比,LPS+NPV-ECM组对葡萄糖代谢、脂肪酸代谢、三羧酸循环、谷氨酸和谷氨酰胺代谢的影响显著(图4F)。NPV-ECM处理影响小分子的转运,特别是维生素、核苷、无机离子、氨基酸、寡肽、胆盐、有机酸、金属离子和胺化合物(图4F)。这表明NPV-ECM对细胞外营养物质的选择性通透性影响了细胞内代谢产物的转运。
图5. NPV-ECM在伤口愈合中的新生血管特性
NPV-ECM用于伤口愈合的血管生成特性
血管损伤可导致局部营养供应不足,进而导致炎症细胞失活。形成血管的能力对于恢复生理免疫微环境很重要。研究者研究了NPV-ECM对血管生成(从原始微血管系统发育出新毛细血管的过程)的影响。内皮细胞是血管的必需细胞,并在血管生成中发挥重要作用。研究表明,小的EV可以促进血管形成。由于NPV-ECM可作为释放NPV的载体,因此我们探索了NPV是否具有类似的性质。研究者发现NPV的蛋白质成分主要与血液微粒相关(图5A)。GO分析发现,NPV蛋白与血管生成(即补体成分C6、补体C5和补体C3)、细胞迁移(即fibulin-1和纤维连接蛋白)和细胞-基质黏附(即纤维蛋白原α链、纤维蛋白原γ链和玻连蛋白)显著相关(图5B)。然后,研究者研究了NPV如何被人脐静脉内皮细胞(HUVECs)摄取。采用内吞相关抑制剂研究细胞摄取通路。特别选取氯丙嗪、filipin、wortmannin和细胞松弛素D抑制不同的内吞途径。流式细胞术显示,NPV的细胞摄取被抑制剂细胞松弛素D或4 oC抑制(图5C-5E),表明NPV主要通过吞噬作用进入HUVECs;内化效率为28.4%。
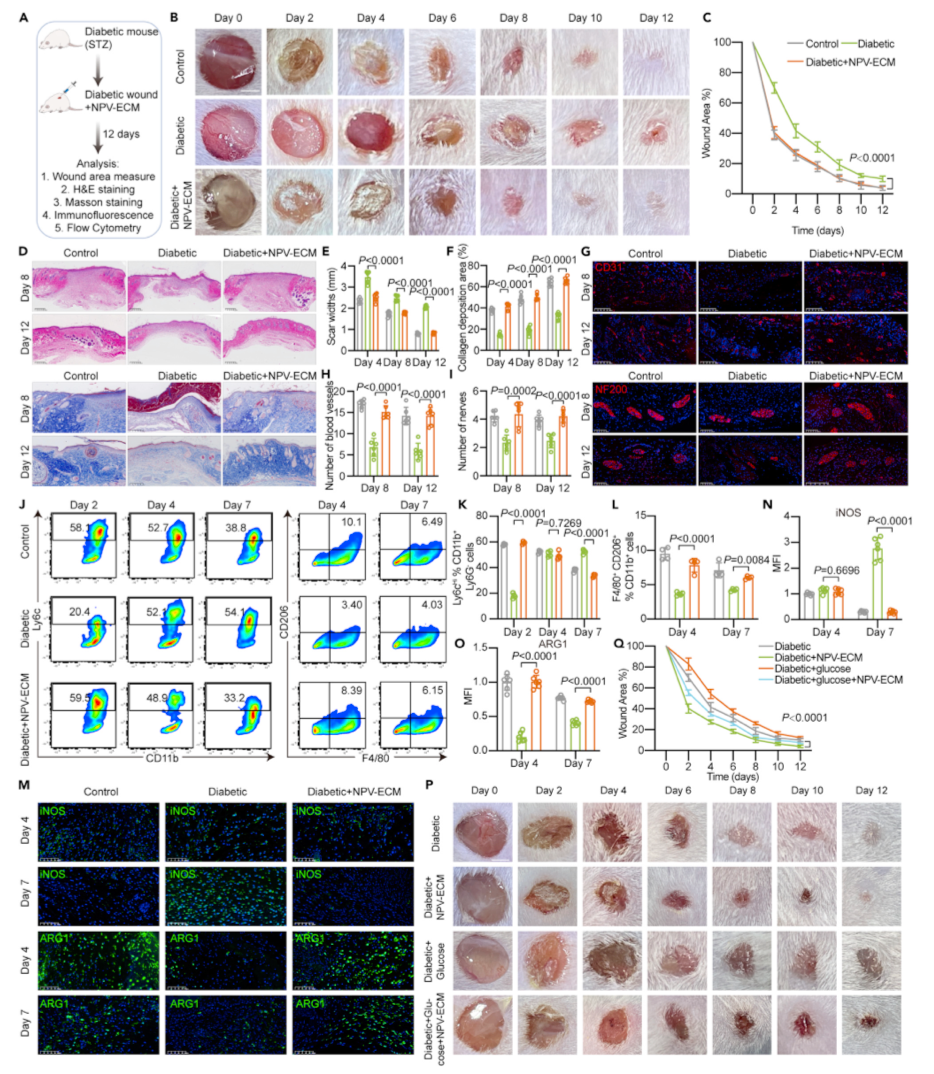
图6. NPV-ECM对糖尿病小鼠创面的体内治疗作用
NPV-ECM对糖尿病小鼠创面的体内治疗作用
由于NPV-ECM可通过其选择性通透性改变巨噬细胞代谢,促进血管生成,因此我们研究了NPV-ECM对糖尿病小鼠创面的治疗作用。对糖尿病小鼠创面进行NPV-ECM处理(G3组)。以未处理的糖尿病小鼠创面(G2组)和正常小鼠创面(G1组)作为对照。随时间推移对伤口进行测试(图6A);在12天的观察期间,经NPV-ECM治疗的糖尿病小鼠和正常小鼠的创面愈合速度比未经治疗的糖尿病小鼠的创面快得多(图6B和6C)。第4天,G1和G3的创面面积分别减少至原来的25.7%和27.0%,而G2的创面面积减少至原来的41.6%。12 d后,G1和G3的创面面积分别是G2的2.4倍和2.6倍,证实了研究者的NPV-ECM水凝胶具有优良的创面愈合能力。伤口愈合是一个复杂的生物学过程,包括凝血、炎症、增殖和重塑。苏木精-伊红(he)染色显示,与G2相比,G1和G3的再上皮化和真皮再生水平较高,瘢痕形成程度较低(图6D、6E和S13)。Masson三色染色显示G1和G3比G2有更多的胶原沉积(图6D、6F和S13)。伤口愈合需要新生血管来转运营养物质。研究者使用CD31免疫荧光染色来表征形成 微血管。第8天,G1和G3的新生血管较G2明显(图6G和图6H)。随着时间的推移,微血管的形成逐渐增多,但在第12天,G2组微血管仍然稀疏。神经是上皮的重要组成部分,糖尿病皮肤溃疡可并发神经损伤。研究者通过神经丝的免疫荧光染色来评价神经纤维的再生。第8天和第12天,G1和G3的神经密度高于G2,说明NPV-ECM可以促进神经元的生长(图6G和图6I)。总之,研究者的结果表明,NPV-ECM可以加速糖尿病创面的愈合,并促进糖尿病创面微血管和神经纤维的形成。
【小结】
研究者成功制备了一种天然ECM水凝胶。血浆中的血小板被挤出成纳米级。通过添加凝血酶,富含npv的血浆转化为水凝胶,可通过分子间相互作用高度选择性地限制人血清中代谢物的运输;低pKa和H供体的分子穿透NPV-ECM膜的阻力较低。NPV-ECM可通过饥饿效应系统重塑代谢网络,减少炎症巨噬细胞内过量代谢物(糖酵解、磷酸戊糖途径、脂肪酸代谢和TCA循环中的代谢物积累),最终促进血管生成和糖尿病创面修复。